肝脏胰岛素抵抗(IR) 和脂肪变性是代谢性相关肝病的主要特征,特别是在非酒精性脂肪性肝病 (NAFLD) 和2型糖尿病等代谢疾病中。肝脏IR有可能造成心血管疾病的严重负担并通过恶性循环导致患者发病和死亡。目前肝脏IR被认为是外周IR的一个早期步骤和优先事件,通常先于NAFLD和肥胖的发生。在生理状况下,PI3K招募并磷酸化Akt,抑制糖异生和糖原合酶,减少肝葡萄糖产生。然而,肥胖和NAFLD患者通过内源性代谢损伤相关分子模式诱导的无菌性或局部炎症,进而通过靶向Akt失活来损害胰岛素信号通路。虽然代谢性无菌炎症对肝脏IR至关重要,但是目前还缺乏有前景的策略克服炎症屏障,直接影响或干预肝脏IR和脂肪变性。
近日,中国科学技术大学临床医学院翁建平教授团队在Science Bulletin发表了题为“Hepatocyte NLRP3 interacts with PKCε to drive hepatic insulin resistance and steatosis”的研究论文,通过组学筛选鉴定到肝细胞NLRP3是肝脏IR的重要诱导分子,以及进一步证实其在人和小鼠NAFLD模型肝脏组织中表达增加。功能上,肝细胞特异性NLRP3功能丧失或获得分别改善或加重高脂饮食 (HFD) 诱导的肝脏IR及脂肪变性。机制上,NLRP3直接结合并促进蛋白激酶C蛋白 (PKCε) 的激活,从而损害肝脏胰岛素信号通路和增加脂肪变性;相反,抑制PKCε明显阻断HFD诱导的NLRP3缺陷小鼠的有益作用。此外,筛选发现转录因子阴阳1 (YY1) 调控NLRP3启动子。治疗上,肝脏NLRP3敲低减轻瘦素受体缺陷 (db/db) 小鼠的肝脏IR和脂肪变性。同时,药理抑制NLRP3显著减轻饮食诱导的代谢紊乱。
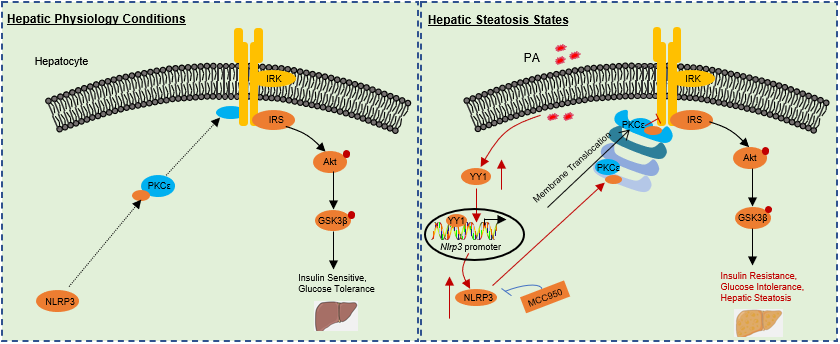
NLRP3如何驱动肝脏IR和脂肪变性的模式图
综上,本研究揭示了NLRP3是肝脏IR和脂肪变性的直接内源驱动因素,并建立了YY1-NLRP3-PKCε轴作为NAFLD的潜在治疗靶点。
中国科学技术大学生医部秦伟伟博士后为本文的第一作者,中国科学技术大学临床医学院翁建平教授为本文的通讯作者,本工作得到了中国科学技术大学生医部周荣斌教授的大力帮助;同时,该研究是在科技部重点研发计划项目,国家自然科学基金,中科院先导项目和安徽省自然科学基金等经费的资助下完成。
论文链接:https://www.sciencedirect.com/science/article/pii/S2095927323003717

