代谢重编程已被确定为癌细胞的基本标志之一。特别是,谷氨酰胺代谢为维持癌细胞的生长提供了重要的碳和氮来源。肿瘤细胞对谷氨酰胺的高度依赖,通常称为谷氨酰胺成瘾,这为发展谷氨酰胺饥饿疗法提供了理论基础。基于这一理念,科学家们已经探索了多种策略,包括通过抑制谷氨酰胺转运蛋白(例如SLC1A5)来实现谷氨酰胺的耗竭,以及通过抑制谷氨酰胺酶(GLS)来阻断谷氨酰胺的分解途径。然而,尽管这些策略在理论上具有吸引力,它们在临床应用中的效果却不尽如人意。这种有限的疗效可能与肿瘤细胞在谷氨酰胺饥饿条件下的适应性生存机制有关。过往人们一直致力于确定谷氨酰胺剥夺疗法中肿瘤细胞适应性生存的根本原因,然而,有一个悬而未决的问题。尽管人们普遍认为肿瘤细胞会响应谷氨酰胺剥夺而启动自噬,以应对氮和碳源的短缺,但实际上,即使在长时间的谷氨酰胺剥夺下,肿瘤细胞不会经历广泛、过度的自噬。这表明肿瘤细胞可能具有内在机制来防止自噬的不受控制的激活,并在谷氨酰胺剥夺下维持存活。这种机制的发现对于我们理解肿瘤细胞如何在代谢压力下存活具有重要意义,并可能为开发新的癌症治疗策略提供新的视角。

近日,中国科学技术大学临床医学院刘连新教授团队在Cell Discovery发表题为“IFRD1 promotes tumor cells “low-cost” survival under glutamine starvation via inhibiting histone H1.0 nucleophagy”的研究论文,本研究揭示了干扰素相关发育调节因子1(IFRD1)在谷氨酰胺饥饿期间肝细胞癌(HCC)细胞适应性存活中的关键作用。研究发现,IFRD1在谷氨酰胺饥饿下诱导表达,并通过以 TRIM21 依赖性方式促进关键自噬调节因子 ATG14 的蛋白酶体降解从而抑制自噬过程。在谷氨酰胺剥夺状态下靶向IFRD1会增加自噬通量,引发癌细胞自噬性死亡。这种死亡主要是由于组蛋白H1.0的核自噬降解所触发的。值得一提的本工作中首次发现H1.0会发生自噬性降解,这也是继Lamin和SIRT1之后,目前第三个被报道在病理条件下被核自噬降解的底物。进一步的研究发现,H1.0的核自噬降解会导致与核糖体和蛋白质生物合成相关的基因的染色质可及性增强,这反过来又促进了蛋白质的合成。最终在谷氨酰胺缺乏、氮源受限的情况下,肿瘤细胞由于蛋白质合成的过度增加,导致肿瘤细胞耗竭死亡。更有趣的是,在动物模型中,单独敲除IFRD1或使用谷氨酰胺酶-1选择性抑制剂CB-839均未显示出显著的抗肿瘤效果。然而,当这两种策略联合使用时,却展现出了显著的肿瘤抑制效果。这一发现为开发新的癌症治疗策略提供了新的视角,尤其是在利用肿瘤细胞对谷氨酰胺的依赖性方面。
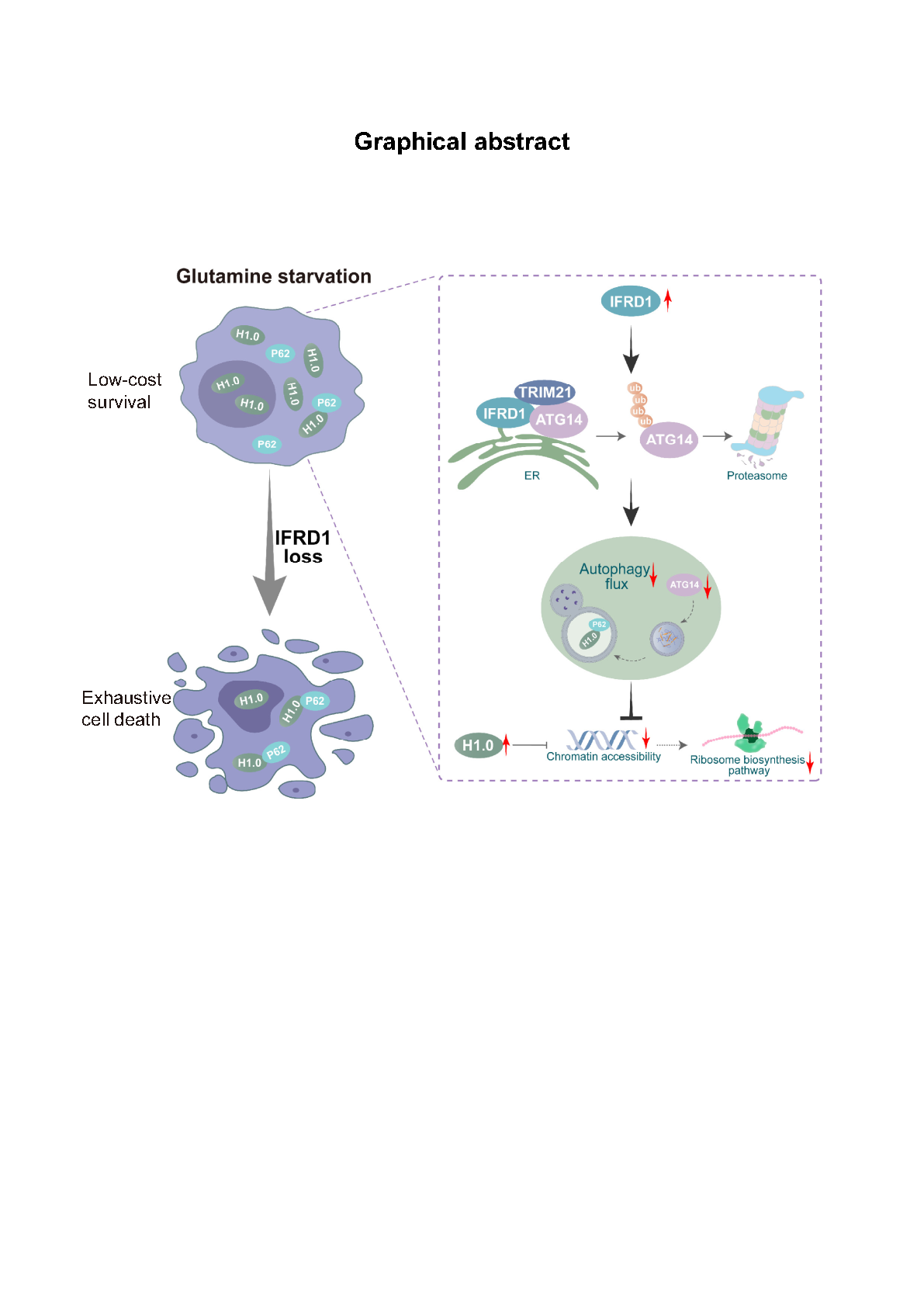
谷氨酰胺饥饿下IFRD1如何维持肿瘤细胞长期生存模式图
综上所述,本研究揭示了IFRD1如何支持癌细胞在谷氨酰胺饥饿下的适应性生存,为开发以IFRD1为靶点的新型抗癌疗法提供了有力的科学支持。
中国科学技术大学生医部黄亚彬博士、中国科学技术大学附属第一医院孟凡征博士后、中国科学技术大学生医部曾陶飞博士为本文的第一作者,中国科学技术大学临床医学院刘连新教授、中国科学技术大学生医部特任副研究员孙雪丹、郑州大学吴缅教授及中国科学技术大学附属第一医院尹大龙教授为本文的通讯作者。本工作得到南京医科大学第一附属医院浦立勇教授的大力支持。本研究得到国家重点研发计划、国家自然科学基金、安徽省高校协同创新项目、安徽省重点研发计划、安徽省自然科学基金、中国博士后科学基金、科大新医学项目的资助。
论文链接:https://www.nature.com/articles/s41421-024-00668-x
