嵌合抗原受体(chimeric antigen receptor, CAR)T细胞疗法是近年来细胞免疫治疗领域的重大突破。通过基因工程改造使T细胞表达靶向特定抗原的嵌合受体,CAR-T细胞能识别并消灭表达相应抗原的靶细胞,达到治疗目标。2021年德国埃尔朗根-纽伦堡大学Georg Schett教授首次将靶向CD19的CAR-T疗法应用于复发难治性系统性红斑狼疮(SLE),患者致病性B细胞被迅速清除,病情快速缓解,随后国内外多个研究团队在CAR-T治疗自身免疫病的临床探索中不断取得新的进展,显示了该疗法卓越的临床前景。然而,传统的CAR-T细胞疗法面临生产工艺复杂、制备周期长、成本高昂等多项挑战,且患者在接受CAR-T治疗前还需要进行化疗清淋预处理,大大增加了感染风险。上述因素极大限制了CAR-T疗法的广泛应用。
为解决传统CAR-T疗法的痛点,近年来基于脂质纳米颗粒(LNP)或慢病毒为载体递送mRNA的技术应运而生。该技术通过LNP将编码CAR的mRNA靶向递送至体内T细胞,使其在体内原位表达CAR蛋白,有望克服传统CAR-T疗法的众多挑战,显著缩短治疗周期,无需清淋预处理并大大降低生产成本,为患者带来更便捷和更经济的选择。

北京时间2025年9月18日,国际权威医学期刊新英格兰医学杂志(The New England Journal of Medicine)在线发表了中国科大附一院(安徽省立医院)风湿免疫科陈竹教授团队的创新性临床研究成果——In vivo CD19-CAR T-Cell Therapy for Refractory Systemic Lupus Erythematosus。该研究在全球范围内首次报道了基于LNP的体内CAR-T技术治疗难治性系统性红斑狼疮的初步结果,标志着我国在自身免疫病前沿治疗领域取得重要原创性突破。

该研究中使用的药物为新型靶向CD8的LNP递送编码CD19-CAR的mRNA(HN2301,图1)。在临床前研究中,HN2301成功实现了食蟹猴体内T细胞重编程为CD19-CAR T细胞,并高效清除了循环和组织B细胞,安全性良好。在获得伦理批准和患者知情同意后,研究共纳入5例复发难治性SLE患者,均为女性,其中4例合并狼疮肾炎,年龄31-46岁,疾病活动评分SLEDAI-2K为8-22分,病程7-18年,既往曾使用多种免疫抑制治疗疗效不佳。治疗方案采用剂量递增策略,患者接受单次或多次静脉输注HN2301。结果显示,给药6小时后,外周血即检测到CD8+CD19-CAR T细胞,B细胞水平降低至给药前10%,增加剂量重复给药后,患者外周血B细胞实现完全耗竭(<1 B细胞/μl),并持续7-10天。检测表明,外周血CD19-CAR T细胞在每次输注后6小时达到峰值,比例最高达60%以上,2-3天内降至基线水平。随访观察表明,所有患者的SLEDAI-2K评分在治疗后持续下降,抗核小体抗体和抗dsDNA抗体快速下降,部分患者补体水平恢复正常。在安全性评估中,仅观察到低级别细胞因子释放综合征,未发生神经系统毒性、肝肾功能和血液系统损害等不良反应。
本研究首次证明了基于靶向LNP的体内CAR-T治疗SLE的可行性。这也是中国科大附一院风湿免疫科团队继2025年1月在国际知名期刊《Cell Research》发表应用CAR-T治疗难治性类风湿关节炎研究成果后,在自身免疫病治疗领域取得的又一重要进展。随着技术的不断成熟和完善,体内原位生成CAR-T细胞有望成为自身免疫病治疗领域的一项颠覆性技术,真正实现细胞免疫治疗的普及化和规模化,为广大自身免疫病患者带来新希望。论文共同第一作者为中国科学技术大学生命科学与医学部临床医学博士研究生王倩、虹信生物CSO肖泽秀博士、中国科大附一院检验科副研究员郑旭和安庆市立医院风湿免疫科王贵红主任医师。论文责任通讯作者为陈竹教授(Lead PI),德国埃尔朗根-纽伦堡大学Georg Schett教授和虹信生物CEO查高峰博士为共同通讯作者。本研究得到国家自然科学基金、安徽省自然科学基金和安徽省卫生健康科研项目的资助。
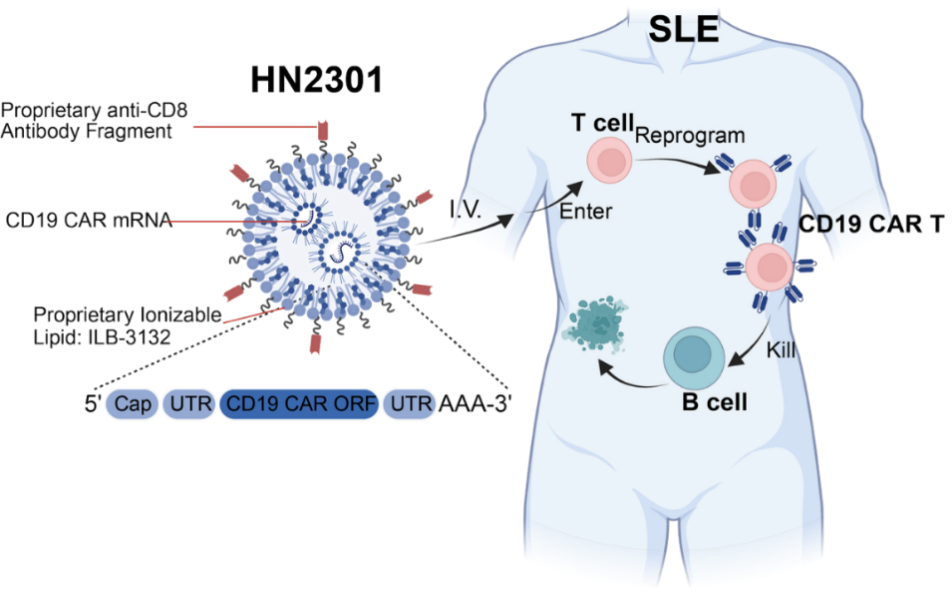
图1 HN2301体内原位生成CD19-CAR T细胞治疗SLE机制示意图
